
末梢血の「血管の基」を使って
血管を再生させる
( 2012/03/26 )
※東京都健康長寿医療センターは、実施施設から外れています。(2020年11月時点)
下肢の動脈が慢性的に閉塞する閉塞性動脈硬化症(arteriosclerosis obliterans:ASO)は、安静時痛や潰瘍(かいよう)、壊疽(えそ)を起こして重症(重症下肢虚血: critical limb ischemia: CLI)になると、最悪の場合、足を切断しなければならなくなります。このような症例に有効な治療法が、「末梢血単核球細胞移植による血管再生治療」です。この治療法は2005年6月に先進医療に承認され、12年3月1日現在、全国の9つの医療機関が実施しています。高齢者医療を専門とする東京都健康長寿医療センターでは、合併症を持つ高齢の患者にも安全に行えるように工夫しています。
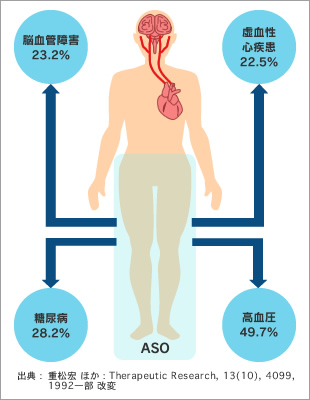
動脈硬化が進行すると様々な病気を引き起こします。動脈が狭くなったり塞がったりして血流が滞るため、下肢の場合は足の冷感やしびれ、歩くとふくらはぎが痛くなる間歇性跛行(かんけつせいはこう)などの症状が現れます。これが閉塞性動脈硬化症(ASO)です。症状がさらに進行すると、安静時痛や潰瘍、壊疽に至ります(図1)。四肢に動脈硬化がある場合、ほかの臓器でも動脈硬化を起こしている可能性が高く、ASOの患者は糖尿病や高血圧、脳梗塞、虚血性心疾患などを合併する率が高くなっています(図2)。その逆も然りで、こうした疾患を持っている患者はASOの合併率も高いと言えます。
ASOの標準的な治療法は、薬物治療や運動療法、バルーン、あるいはステントで血管を拡張する血管内治療、外科的バイパス術といった血行再建術です。しかしながら、血行再建が困難な症例や適応にならない症例もあります。このような症例では壊疽が拡大して感染を併発すると、切断に至る可能性が高く、予後も不良で、5年生存率はがんとあまり変わりません(図3・4)。切断時点での動脈硬化の進行度だけでなく、切断後の血液循環の変化が影響すると考えられます。
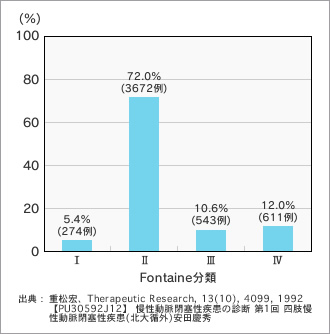
病院でASOの治療を受けている患者は、Fontaine分類(ASOの重症度分類)Ⅱ度の間歇性跛行患者がいちばん多い。一方、Ⅲ度の安静時痛やⅣ度の潰瘍・壊疽による治療開始も少なくない(末梢血行障害の治療薬の開発治験に参加することが多い施設のアンケート調査5100症例)
「切断」というと、極力足を残そうと患部ぎりぎりで切断するものと想像するでしょう。ところが実際には想像以上に大きく切断する必要があります。東京都健康長寿医療センター循環器内科の坪光雄介専門部長(写真)は次のように説明します。「血流の著しく悪い感染創部はいったん壊死が始まると進行が早く、足の指だけにはとどまらず足底部に及んでいる場合があります。このような状況下で足関節を残す最小限の切断(足の指のみ、あるいはかかとを残す小切断)にしてしまうと、切断創部で傷がふさがらず体幹に近い側の近位部にまで壊死範囲が進行し、再手術をする可能性が高くなります。その為、手術は一度きりで済むように、確実に切断創部の治癒の望める近位部での大切断(膝上・下)が選択されます」。こうした症例において、切断の回避と予後の改善が期待され、最後の砦となる治療法が血管再生治療なのです。
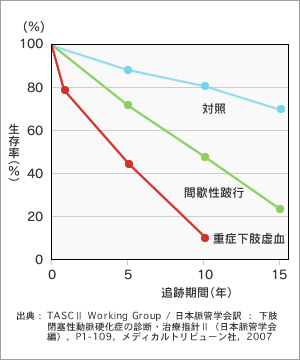
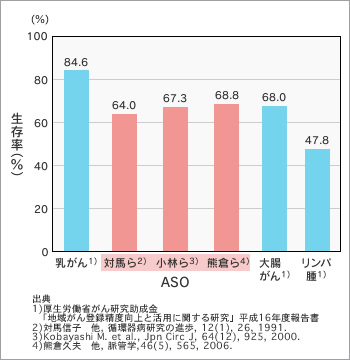
重症下肢虚血(FontaineⅢ度・Ⅳ度)患者では、1年後には約20%が死亡、さらに5年生存率は約40%、10年生存率は約10%と極めて予後が悪いことが示されている。予後は、間歇性跛行患者に比べても極めて不良である。また、ASOはがんの5年生存率と比較しても、大腸がんと同程度で、乳がんより低く、予後不良である
血管再生治療には「骨髄単核球細胞移植(骨髄法)」と「末梢血単核球細胞移植(末梢血法)」があります。骨髄には臓器や組織の基になる幹細胞が含まれており、骨髄法は「骨髄液から」採取した幹細胞を虚血肢に移植する方法です。これは有効性が確認されていますが、全身麻酔下で骨髄液を約600ml採取するため、特に高齢者や合併症を多く抱えて全身状態が悪い重症患者に対しては負担が大きく、治療適応が限定される可能性がありました。
東京都健康長寿医療センターでは、「血管内の血液(末梢血)」を使う末梢血単核球細胞移植を採用しています。この場合、自動血液成分分離装置を用いて無麻酔下で経静脈的に単核球細胞を採取することができます。これは技術的に確立した、きわめて身体的負担が少ない手技です。また、骨髄を採取する方法と違い、低侵襲ゆえ繰り返し行うことが可能となりました。
図5●移植前後の比較
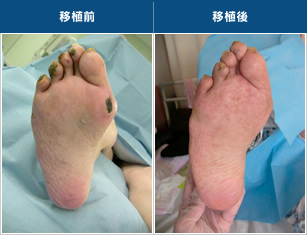
移植から約1年後、壊疽がきれいに消失した
末梢血法が可能になったのは、血管の基になる「血管内皮前駆細胞(endothelial progenitor cell:EPC)」が骨髄より少ない(骨髄単核球と比較して約1%程度)ものの、体内を流れる末梢血中にも単核球分画(白血球の成分)の一部として存在することが発見されたことによります。また、末梢血法は、骨髄法と比較しても同等の治療効果が得られることも明らかになっています。血管新生の主たるメカニズムとしては、単核球細胞移植によって再生した骨格筋細胞から分泌される、血管増殖因子の亢進(パラクリン効果)の関与が考えられています。
末梢血法においてはEPCが少ないため、G-CSFという白血球を増加させる薬剤を使って骨髄のEPCを末梢血へ動員させる方法が一般的です。ただ、これは脳梗塞や心筋梗塞を誘発する可能性が指摘されています。本治療の対象は、脳梗塞や心筋梗塞などを合併していたり、リスクが高い患者です。またG-CSFは白血球を極端に増加させるため、がん化の危険も生じます。G-CSFを用いない方法は、世界で初めて千葉大学循環器内科小室教授(現、大阪大学循環器内科教授)のもとで始められました。成績が骨髄法と同等であり、04年に同センターにおいて高齢者を対象とした共同研究として正式に導入しています(担当代表:上田清悟循環器内科副部長)(図5)。同センターでは患者の年齢に上限を設けておらず、現在までにこの治療を受けた患者の最高齢は95歳(平均年齢76歳)です。
本治療の適応症は、ASOやバージャー病といった重症の末梢性血管疾患で、前述した標準的な治療で効果不十分、または標準治療の適応外の症例が対象です。バージャー病は、末梢動脈に閉塞性の内膜炎を起こし、手足の先端に潰瘍や壊疽を引き起こす疾患です。原因は不明ですが、20代〜30代の比較的若い喫煙男性に発症しやすい傾向があります。
次のような症例は血管再生治療の適応外となります。がん患者および過去5年以内にがんの既往のある患者、検査の結果、がんの可能性があると診断された患者については、本治療の血管新生によって腫瘍の増大や転移を促進する危険があるため、血管再生治療の適応から除外されます。本治療を受けるに当たり、全身のがん検診を行うのはこのためです。未治療の糖尿病網膜症も、血管再生治療の過程で分泌される血管増殖因子によって症状が悪化する危険があるため、適応外です。虚血性心疾患が疑われる症例については、動脈硬化性病変の悪化が懸念されるため、冠動脈造影検査を行い、必要に応じて冠血行再建を行ってから細胞移植を実施しています。インフォームドコンセントが得られない、高度の認知症などで主治医が不適当と判断するケースも適応外になります。また、壊疽が広がっていて感染症を起こしている場合も、細胞移植により逆に感染を悪化させてしまう恐れがあり適応外となります。そうした状態で行っても結局、大切断に至れば、患者のダメージはかなり大きいため、適応例は慎重に見極めているそうです。
同センターでは04年8月から本治療を開始し、07年10月に先進医療の認定を受けました。これまでに治療した28例の有効率は7割を超え、移植後6カ月の時点で「潰瘍面積が4分の1以上縮小化」「自覚症状の改善」が見られました。病状によりますが、本治療で大切断を逃れ、最低でも踵を温存できれば、リハビリ次第ですが日常生活に復帰できます。一方、治療後に大切断に至ったり、感染症などで死亡するケースが3割近くあり、治療後にがんを発症したケースも2例ありました。術前に、がんのスクリーニングを厳重に行っていても発見が難しいがんもあります。本治療を受けるに当たっては、こうしたリスクもあることを十分理解する必要があります。
次回は、血管再生治療の実際を紹介します。